- Butano
- 3-metil-heptano
- 3,3 dimetilheptano
- 3-etil-4-metil-octano
- 3-isopropil-heptano
- 3-Noneno
- 3,5-decadieno
- Propino
- 2,4-octadien-6-ino
- 3-Metil-1,3-pentadieno
- 1,3-ciclopentadieno
- Ácido pentanoico
- Ácido 3-metil-5-hexenoico
- Butanoato de propilo
- Etanoamida
- 2-carboxi-pentanodioico
- Propanonitrilo
- Ácido 3-ciano-butanoico
- Butanal
- 2-metil-4-hexenodial
- Ácido 2-formil-butanodioico
- Ácido benzoico
- 2,3-pentanodiona
- 3,3-dimetil-2-pentanona
- 3-oxo-pentanonitrilo
- 1,2,3,4-butanotetraol
- 1-pentin-3-ol
- 3-hidroxi-4-hexenal
- Metanoamina
- 3-amino-4-hexenal
- Metoxietano
sábado, 22 de octubre de 2016
FORMULACIÓN QUÍMICA ORGÁNICA (PREPARACIÓN PARA EL EXAMEN)
Vamos a formular una serie de compuestos químicos orgánicos, agrupados por tipo de molécula:
SOLUCIÓN EJERCICIOS ISOMERÍA DE AYER
Como segunda parte de la entrada de ayer, pondré la solución de los ejercicios propuestos, comienzo por...
Ejercicio para practicar, ¿cuáles de las siguientes molécula presentan isomería óptica?
CH2=CH-CH3
CH3-CH2-CO-CHOH-CH3
CH3-CHBr-CH3
CH3-CHOH-C(CH3)OH-COOH
En el primer compuesto químico no hay ningún carbono unido a cuatro sustituyentes distintos entre sí. No hay pues isómeros ópticos. Lo mismo cabe decir del tercero de ellos. En cambio en el segundo el carbono que contiene un grupo funcional acohólico sí:
CH3-CH2-CO-CHOH-CH3 porque está unido a CH3CH2CO, a un hidrógeno, a un OH y a un metilo. Cuatro sustituyentes distintos, por lo que es un carbono asimétrico y habrá isómeros ópticos.
Lo mismo cabe decir del último, pero además hay dos carbonos asimétricos,
CH3-CHOH-C(CH3)OH-COOH
Si analizamos cada uno de ellos, están unidos a cuatro grupos diferentes, comencemos por el carbono número dos: está unido a un metilo, un Hidroxilo, un grupo carboxílico, y a una cadena de dos carbonos. En el carbono número tres: se une a un metido, un hidrógeno, un hidroxilo, y otra cadena de dos carbonos.
Como hay dos carbonos asimétricos, la presencia de isómeros ópticos está asegurada, y en mayor número que en el ejemplo anterior.
Segundo ejercicio: Ejercicio para practicar, ¿cuáles de las siguientes molécula presentan isomería geométrica? En caso afirmativo dibuja los isómeros cis y trans.
CH3-CH=CH-Cl CH3-CH=CH-CH=CH2 CH3-CCl=CCl-CH3
Todos los compuestos presentan isómeros geométricos, pero subrayar que en segundo compuesto, sólo en el doble enlace situado en el carbono número tres, porque el del carbono número uno se une el primer átomo a dos hidrógenos y por tanto sus sustituyentes son iguales:
En el segundo compuesto hemos agrupado la cadena hidrocarbonada bajo el símbolo de "R".
Ejercicio para practicar, Escribe cuatro isómeros de posición de las siguientes moléculas:
CH3-CH2-CH2-CH(CN) -CH2-CH2-COOH
CH3-CH2-CH2-CH(OH) –C0-CH3
CH3-CH2-CH(CN)-CH2 -CH2-CH2-COOH
CH3-CH2-CH2-CH(CN) -CH2-CH2-COOH
CH3-CH2-CH2 -CH2-CH(CN)-COOH
CH3-CH2-CH2 -CH2-CH(CN)-CH2-COOH
CH3-CH2-CH2-CH(OH) –C0-CH3
CH3-CH2-CO-CH(OH) -CH2-CH3
CH3-CH2-CH(OH)-CH2 –C0-CH3
CH3-CH(OH)-CH2-CH2–C0-CH3
Ejercicio para practicar, Escribe algunos isómeros de función de las siguientes moléculas:
CH3-CH2-CO-CH2-CHOH-CH2-NH2
CH3-CH2-CH2-O-CH2-CH2-COO-CH2-CH3
CH3-CH2-CH2-CHOH-CH2-CONH2
CH3-CH(NH2)-CH2-CH2-CH2-COOH
CH3-CH2-CH(OH)-CH2-CH2-COO-CH2-CH3
CH3-CH2-CH2-O-CH2-CH2--CH2--CH2-COOH
Ejercicio para practicar, Escribe cuatro isómeros de cadena de la siguiente molécula:
CH3-CH2-CH2-CH=CH-CH2-CH(CH2CH3)-CH2-CH2-CH2-CH3
CH3-CH2-CH2-CH=CH-CH2-CH(CH2CH2CH3)-CH2-CH2-CH3
CH3-CH(CH3)-CH2-CH=CH-CH2-CH(CH2CH3)-CH2-CH2-CH3
CH3-CH(CH3)-CH=CH-CH2-CH(CH2CH3)-CH(CH3)-CH2-CH3
CH3-CH2-CH2-CH=CH-CH2-C(CH2CH3)2-CH2-CH3
viernes, 21 de octubre de 2016
EJERCICIOS DE ISOMERÍA PARA PRACTICAR
Voy a proponer unos ejercicios de isomería sencillos, para practicar de cara a un examen en la que os pueden preguntar sobre este tema. Recordemos que sustancias isómeras son aquellas que teniendo los mismo átomos de cada especie dentro de la molécula, es decir igual fórmula molecular, los átomos se enlazan de forma diferente y dan lugar a moléculas diferentes.
ISÓMEROS ÓPTICOS:
La primera pregunta es sobre isómeros ópticos, normalmente nos ponen unas fórmulas químicas, más o menos desarrolladas, y debemos decir si hay o no posibles isómeros ópticos, y qué carbonos de la cadena son los responsables.
Aunque en la práctica real es todo más complicado, para un 1º de bachillerato nos conformamos con identificar carbonos asimétricos que tienen cuatro enlaces simples. En estos casos, el carbono será asimétrico cuando los cuatro enlaces conduzcan a cuatro sustituyentes diferentes. Por ejemplo:
ISÓMEROS ÓPTICOS:
La primera pregunta es sobre isómeros ópticos, normalmente nos ponen unas fórmulas químicas, más o menos desarrolladas, y debemos decir si hay o no posibles isómeros ópticos, y qué carbonos de la cadena son los responsables.
Aunque en la práctica real es todo más complicado, para un 1º de bachillerato nos conformamos con identificar carbonos asimétricos que tienen cuatro enlaces simples. En estos casos, el carbono será asimétrico cuando los cuatro enlaces conduzcan a cuatro sustituyentes diferentes. Por ejemplo:
CH3-CH2-CHCl-CH3
El carbono señalado de rojo es asimétrico, se une a un hidrógeno, a un cloro, a un metilo y a un etilo. Por tanto cuatro sustituyentes diferentes, es un carbono asimétrico y la molécula presentará isómeros ópticos.
Debemos tener en cuenta para finalizar,que en una molécula puede haber varios isómeros ópticos. Dados los objetivos del curso, en un ejercicio práctico sólo nos limitaremos a identificar moléculas que pueden tener isómeros ópticos, pero no los vamos a dibujar porque correspone a cursos superiores.
Ejercicio para practicar, ¿cuáles de las siguientes molécula presentan isomería óptica?
CH2=CH-CH3
CH3-CH2-CO-CHOH-CH3
CH3-CHBr-CH3
CH3-CHOH-C(CH3)OH-COOH
ISÓMEROS GEOMÉTRICOS:
Ligados a la presencia de un doble enlace, (de nuevo en la realidad las situaciones son más variadas), por tanto es necesario tener delante un alqueno. Pero no todos los alquenos tienen isómeros geométricos, sólo aquellos que tienen dos sustituyentes distintos en cada átomo de carbono que participa del doble enlace, por ejemplo el CH2=CH-CH3 no los tiene porque aunque el carbono de rojo está unido a un hidrógeno y a un metilo, el otro carbono del doble enlace no cumple con la condición, ya que se une a dos hidrógenos, y obviamente son iguales entre sí. Caso aparte es el del CH3-CH=CH-CH3 porque los dos carbonos del doble enlace se unes a sustituyentes distintos, en este caso el hidrógeno y el metilo cada uno.
Una vez que hemos localizado la molécula susceptible de tener isómeros geométricos, y además la zona de la misma que es responsable de este hecho, lo dibujamos, porque a diferencia de los isómeros ópticos, estos son fáciles de representar.
Como no tengo otro editor de compuestos químicos, lamento tener que escribirlos de forma supersimplificada en este ejemplo: CH3-CH=CH-CH3
El primero es la forma CIS, con los dos sustituyentes "más voluminosos" en el mismo lado del doble enlace, y en el de la derecha el TRANS, donde los sustituyentes más voluminosos están en lados alternos.
Ejercicio para practicar, ¿cuáles de las siguientes molécula presentan isomería geométrica? En caso afirmativo dibuja los isómeros cis y trans.
CH3-CH=CH-Cl CH3-CH=CH-CH=CH2 CH3-CCl=CCl-CH3
ISÓMEROS DE CADENA:
Se trata de cambiar la forma de colocarse los átomos de carbono dentro del esqueleto hidrocarbonado, por ejemplo: CH3-CH2-CH2-CH2-CH2-CH3 CH3-CH2-CH2-CH(CH3)-CH3
Aqui los átomos de carbono dejan de estar los seis en línea, uno tras otro, para colocarse cinso alineados, y uno a modo de rama.
Ejercicio para practicar, Escribe cuatro isómeros de cadena de la siguiente molécula:
CH3-CH2-CH2-CH=CH-CH2-CH(CH2CH3)-CH2-CH2-CH2-CH3
ISÓMEROS DE POSICIÓN:
Otro caso fácil, fácil, porque aquí lo que vamos a modificar es la posición o localizador de la función orgánica que haya en la molécula, por ejemplo o alcohol deja de estar en el átomo número 2 para pasar a estar en el cuatro. Veamos un ejemplo, en este caso el grupo amina, pasa de estar en el carbono número 1 al carbono número 2.
CH3-CH2-CH2-NH2 CH3-CHNH-CH3
Ejercicio para practicar, Escribe cuatro isómeros de posición de las siguientes moléculas:
CH3-CH2-CH2-CH(CN) -CH2-CH2-COOH
CH3-CH2-CH2-CH(OH) –C0-CH3
ISÓMEROS DE FUNCIÓN:
Caso un poquito más difícil del anterior, debemos cambiar el tipo de función orgánica presente en la molécula, y no olvidemos que tenemos que tener siempre el mismo número de átomos. POr ejemplo en la última molécula del ejemplo anterior, si en el mismo carbono estuvieran todos los oxígenos tendríamos un ácido carboxílico o un éster:
CH3-CH2-CH2-CH(OH) –C0-CH3 CH3-CH2-CH2-CH2 –C0O-CH3
CH3-CH2-CH2-CH2 -CH2
C0OH
Ejercicio para practicar, Escribe algunos isómeros de función de las siguientes moléculas:
CH3-CH2-CO-CH2-CHOH-CH2-NH2
CH3-CH2-CH2-O-CH2-CH2-COO-CH2-CH3
jueves, 6 de octubre de 2016
EJERCICIOS SOBRE AMINAS
Formulemos y nombremos aminas, tanto como función principal como en el caso que sean función secundaria.
Etilamina
1-propilamina
2-propilamina
Trimetilamina
N-butil-N-metil-amina
Ácido 3-aminohexanoico
4-metil-pentanal
2-metil-3-pentanoamina
Etilamina
1-propilamina
2-propilamina
Trimetilamina
N-butil-N-metil-amina
Ácido 3-aminohexanoico
4-metil-pentanal
2-metil-3-pentanoamina
CH3-CH2-CH2-CH=CH-NH2
CH3-CHOH-CH2-CH2-NH2
(CH3-CH2)3N
NORMAS DE FORMULACIÓN DE AMINAS
A las aminas las podemos considerar como derivados del
amoníaco, NH3, a efectos de formulación. En una amina, uno de los
hidrógenos unidos al nitrógeno es sustituido por una cadena hidrocarbonada,
dando lugar a una amina primaria. Ejemplo:
CH3-CH2-CH2-NH2
Pero no tiene que pararse ahí, podemos sustituir más
hidrógenos unidos al átomo de nitrógeno dando lugar a aminas secundarias y
terciarias, según las cadenas hidrocarbonadas que partan del átomo de N.
CH3-NH-CH2-CH3
Veamos como se nombran las aminas, como siempre comenzaremos
por el caso en el cual la amina es la función principal, y como algo especial
de este tipo de compuestos, presentamos las aminas primarias que son las más
fáciles. Haremos uso de la terminación “-amina”, precedida del prefijo numeral que indica
cuantos carbonos tiene la cadena principal terminado en “il” o en “ano”, (e incluso eno ó ino si
hubiera insaturaciones). Y cuando sea necesario añadiremos el localizador correspondiente. Si no hubiera localizador se sobreentiende que partimos del carbono número "1" de la cadena.
Propilamina à
CH3-CH2CH2-NH2 Vinilamina à
CH2=CH-NH2
Si hubiera dos o más grupos amino:
H2N-CH2-CH(NH2)-CH2-CH2-NH2
à 1,2,5-pentanotriamina
Si tratamos de una amina secundaria, podemos tener las dos
cadenas hidrocarbonadas iguales o distintas, en el segundo caso se nombran las
cadenas por orden alfabético, anteponiendo una “N” para reseñar que parten del
N amoniacal.
Dimetilamina à CH3-NH-CH3
N-metilpropilamina à CH3-NH-CH2-CH2-CH3
Y haríamos lo propio con aminas terciarias:
N-etil-N-metil-propilamina à CH3-N(CH2-CH3)
-CH2-CH2-CH3
Las aminas que estudiaremos en 1º de bachillerato serán de
este nivel de complejidad, pero la situación se puede ver rebasada en cursos
superiores como en el caso de:
CH3-NH-CH2-CH2-NH-CH2-CH3
Si el grupo amina es función secundaria por coexistir en la
molécula con otra función de rango superior, se nombrará como “amino-“
CH3-CO-CH2-NH2 à 1-amino-propanona
CH3-CH2-CHOH- CH2- CH2-NH2
à 1-amino-3-pentanol
miércoles, 5 de octubre de 2016
EJERCICIOS DE NOMENCLATURA DE ALCOHOLES
Nombrar las siguientes moléculas que contienen un grupo alcohol al menos:
- CH3OH
- CH3-CH(CH3)-CH(CH3)-CH2OH
- CH2OH-CH2-CH2OH
- CH3-C(OH)2-CH3
- CH2=CH-C≡C-CH=CH-CHOH-CH2OH
- CH3-CH2-CH2-CH(CH2CH3)-CHOH-CHOH-C≡CH
- CH2OH-CHOH-CHOH-CO-CH2OH
- CH3-CH(CN)-OH
- CH3-CHOH-CH2-CH2-COOH
- CH3-CO-CO-CH2OH
EJERCICIOS DE FORMULACIÓN DE ALCOHOLES
A continuación podremos una serie de nombres de alcoholes para formularlos:
3-hexanol
ciclopentanol
Etanol
2,3,3-pentanotriol
2-hexen-1-ol
2,4-ciclopentadienol
3,3-dimetil-2-pentanol
Fenol
2-hidroxi-butanonitrilo
3-metil-3-hidroxi-2-hexanona
3-hexanol
ciclopentanol
Etanol
2,3,3-pentanotriol
2-hexen-1-ol
2,4-ciclopentadienol
3,3-dimetil-2-pentanol
Fenol
2-hidroxi-butanonitrilo
3-metil-3-hidroxi-2-hexanona
lunes, 3 de octubre de 2016
NOMENCLATURA DE ALCOHOLES
En la entrada de hoy vamos a aprender como se nombran y
formulan los alcoholes. Los alcoholes con compuestos orgánicos que poseen un
grupo –OH unido a un carbono en sustitución de un H que tuviera este. No debemos
confundirlos con ácidos orgánicos o similares porque en los ácidos el carbono al que está
unido el grupo –OH además tiene un C=O, resultando ser
R–CO-OH.
Como alcoholes tenemos por ejemplo el CH3-OH, o
el CH3-CH2-CHOH-CH3. De nuevo subrayamos que
el grupo –OH es el único sustituyente oxigenado del carbono.
Si el alcohol es función principal, lo nombramos con la terminación
“–ol” al final del nombre de la cadena principal, y si es necesario añadiremos
el localizador para indicar donde reside el grupo alcohólico –OH.
CH3-OH Metanol
CH3-CH2-CHOH-CH3 2-butanol CH3-CH2-CH2-CH2-OH 1-butanol
En este último caso, los dos alcoholes corresponden a
compuestos distintos en la naturaleza, con propiedades diferentes. Tal es el
efecto de tener el grupo –OH en un carbono o en otro.
Si hubiera más de un grupo –OH se nombrará de la forma
acostumbrada como diol,triol, etc…
CH3-CH2-CHOH-CH2OH 1,2-butanodiol
Finalmente, si el grupo alcohólico no fuera la función
principal , se nombrará como función secundaria como “hidroxi-“ con el localizador
si fuera necesario:
CH3-CH2-CHOH-CO-CH3 3-hidroxi-2-pentanona
En el caso del alcohol derivado del benceno, este recibe un
nombre propio aceptado por la IUPAC:
EJERCICIO DE FORMULACIÓN CON CETONAS
Formula los siguientes compuestos químicos en los que intervienen cetonas:
- 2-butanona
- 2,4,7-octanotriona
- Acetona
- 2-metil-3pentanona
- 4-hexen-2-ona
- 3-etil-5-heptin-2-ona
- Benzofenona
- 2-oxo-propanal
- Ácido 3-oxo-butanoico
EJERCICIO NOMENCLATURA DE CETONAS
Nombra los siguientes compuestos químicos en los que intervienen cetonas:
- CH3-CO-CH2-CH2-CH3
- CH3-CH2-CO-CH=CH2
- CH3-C≡C-CO-CH3
- CH3-CO-CO-CH3
- CH3-CH(CH3)-CH2-CO-CH3
- CH3-CO-CH=CH-CH2-CO-CH3
- CH3-CO-CH2-CH2-COOH
- CH3-C≡C-CO-COOH
EJERCICIO DE NOMENCLATURA CON ALDEHÍDOS
Formula los siguientes compuestos químicos:
- Butanal
- Ciclopentanocarbaldehído
- Etanodial
- 3-octen-6-inal
- 3,5-heptadienal
- 2-metil-3,5-hexadienal
- 4-fenil-2-pentinal
- 2-etil-2-metil-propanodial
- Ácido 3-metil-3-formil-butanoico
- Ácido 4-formil-2-pentenoico
EJERCICIO PARA NOMBRAR ALDEHÍDOS
domingo, 2 de octubre de 2016
NOMENCLATURA DE CETONAS
Las cetonas son compuestos químicos en los que existe un
carbono unido doblemente a un oxígeno, y con las dos valencias restantes del
carbono, se une a otros dos átomos de carbono:
I
R-C=0
Donde R y R’ son cadenas de carbono. Se parece a un
aldehído, pero dentro de las cadenas de carbonos, en vez de posición terminal.
Para nombrarlas haremos uso de la terminación –ona, cuando
sea la función principal. (O diona, triona, … si hay más de un grupo C=O).
CH3-CO-CH2-CH3 Butanona CH3-CH2-CO-CH2-CH2-CH2-CH2-CH3 3-octanona
Como el grupo C=O puede estar en cualquier posición dentro
de la cadena, es necesario indicar donde está por medio de un localizador, que
lo elegiremos de la forma acostumbrada, para que sea el número más bajo
posible.
Si el grupo cetónico no es función principal dentro de la
cadena, entonces como grupo secundario lo nombraremos con el localizador y el
prefijo oxo-.
CH3-CH2-CO-CH2-CH2-CH2-CH=O 5-oxo-heptanal
Nombre especiales de cetonas:
CH3-CO-CH3 Acetona
sábado, 1 de octubre de 2016
NOMENCLATURA DE ALDEHÍDOS
Los aldehídos son compuestos orgánicos que poseen un grupo
oxigenado llamado carbonilo, cuyos estructura es la siguiente:
Siempre es un grupo situado al final de las cadenas, con una
de las 4 valencias dedicada al unirse al resto de la cadena de carbono,
señalada como una “R” para abreviar. De las otras tres valencias se dedican dos
a unirse con un oxígeno, y la última a un hidrógeno.
Los aldehídos más sencillos son lineales, con uno o dos de
los dos extremos de la cadena terminando en un grupo “carbonilo”. Para abreviar
en las fórmulas lo vamos a reseñar como “-CH=0”.
Para nombrarlos, cuando la función orgánica principal sea la
propia del aldehído, haremos uso del sufijo “-al”, o “dial” si en cada extremo
hay un carbonilo.
CH3-CH2-CH2-CH=O Butanal
O=HC-CH2-CH2-CH2-CH=O Pentanodial.
En el caso de los compuestos cíclicos sencillos, el aldehído
se nombrará como “–carbaldehído” añadido
al nombre del ciclo.
 Ciclohexanocarbaldehído
Ciclohexanocarbaldehído
 Ciclohexanocarbaldehído
Ciclohexanocarbaldehído
Puede ocurrir, que existan tres grupos aldehído, en ese caso
vamos a considerar que dos forman parte de la cadena principal y el tercero es
una rama de esta, y se nombrará como “formil-“.
O=HC-CH2-CH2-CH(CH=O)-CH2-CH2-CH=O 4-formil-heptanodial
Este tipo de compuestos se puede nombrar de otra forma, pero no la vamos a estudiar en 1º de bachillerato.
Si en el aldehído hay ramificaciones, insaturaciones, etc…
Se nombra de la forma acostumbrada:
CH2=CH-CH2-CH(CH3)-CH2-CH=O 3-metil-5-hexenal
En ocasiones coexisten en una molécula varias funciones
orgánicas y una de ellas será la llamada función principal. Cuando el aldehído
no es la función principal haremos uso del término formil- en sustitución de –al.
O=HC-CH2-COOH
Ácido 2-formil-etanoico
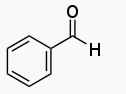
El siguiente compuesto tiene nombre propio y se llama benzaldehído:
Suscribirse a:
Entradas (Atom)